La quantità di calore a temperatura costante. Calcolo della quantità di calore durante il trasferimento di calore, capacità termica specifica di una sostanza
Esercizio 81.
Calcolare la quantità di calore che verrà rilasciata durante la riduzione di Fe 2O3 alluminio metallico se si ottengono 335,1 g di ferro. Risposta: 2543,1 kJ.
Soluzione:
Equazione di reazione:
\u003d (Al 2 O 3) - (Fe 2 O 3) \u003d -1669,8 - (-822,1) \u003d -847,7 kJ
Calcolo della quantità di calore rilasciata quando si ricevono 335,1 g di ferro, produciamo dalla proporzione:
(2 . 55,85) : -847,7 = 335,1 : X; x = (0847.7 . 335,1)/ (2 . 55,85) = 2543,1 kJ,
dove 55,85 è la massa atomica del ferro.
Risposta: 2543,1 kJ.
Effetto termico della reazione
Compito 82.
L'alcol etilico gassoso C2H5OH può essere ottenuto dall'interazione di etilene C 2 H 4 (g) e vapore acqueo. Scrivi l'equazione termochimica per questa reazione, dopo aver calcolato il suo effetto termico. Risposta: -45,76 kJ.
Soluzione:
L'equazione di reazione è:
C 2 H 4 (g) + H 2 O (g) \u003d C2H 5 OH (g); = ?
I valori dei calori standard di formazione delle sostanze sono riportati in apposite tabelle. Considerato che i calori di formazione delle sostanze semplici sono condizionatamente pari a zero. Calcolando l'effetto termico della reazione, utilizzando la conseguenza della legge di Hess, otteniamo:
\u003d (C 2 H 5 OH) - [ (C 2 H 4) + (H 2 O)] \u003d
= -235,1 -[(52,28) + (-241,83)] = - 45,76 kJ
Le equazioni di reazione in cui il loro stato di aggregazione o modificazione cristallina, nonché il valore numerico degli effetti termici, sono indicati vicino ai simboli dei composti chimici, sono dette termochimiche. Nelle equazioni termochimiche, se non diversamente specificato, i valori degli effetti termici a pressione costante Qp sono indicati pari alla variazione dell'entalpia del sistema. Il valore viene solitamente fornito sul lato destro dell'equazione, separato da una virgola o da un punto e virgola. Sono accettate le seguenti abbreviazioni per lo stato aggregato della materia: G- gassoso, e- liquido, a
Se il calore viene rilasciato a seguito di una reazione, allora< О. Учитывая сказанное, составляем термохимическое уравнение данной в примере реакции:
C 2 H 4 (g) + H 2 O (g) \u003d C 2 H 5 OH (g); = - 45,76 kJ.
Risposta:- 45,76 kJ.
Compito 83.
Calcolare l'effetto termico della reazione di riduzione dell'ossido di ferro (II) con l'idrogeno, sulla base delle seguenti equazioni termochimiche:
a) EEO (c) + CO (g) \u003d Fe (c) + CO 2 (g); = -13,18 kJ;
b) CO (g) + 1/2O 2 (g) = CO 2 (g); = -283,0 kJ;
c) H 2 (g) + 1/2O 2 (g) = H 2 O (g); = -241,83 kJ.
Risposta: +27,99 kJ.
Soluzione:
L'equazione di reazione per la riduzione dell'ossido di ferro (II) con idrogeno ha la forma:
EeO (k) + H 2 (g) \u003d Fe (k) + H 2 O (g); = ?
\u003d (H2O) - [ (FeO)
Il calore di formazione dell'acqua è dato dall'equazione
H 2 (g) + 1/2O 2 (g) = H 2 O (g); = -241,83 kJ,
e il calore di formazione dell'ossido di ferro (II) può essere calcolato se l'equazione (a) viene sottratta dall'equazione (b).
\u003d (c) - (b) - (a) \u003d -241,83 - [-283.o - (-13,18)] \u003d + 27,99 kJ.
Risposta:+27,99 kJ.
Compito 84.
Durante l'interazione di idrogeno solforato gassoso e anidride carbonica, si formano vapore acqueo e disolfuro di carbonio СS 2 (g). Scrivi l'equazione termochimica per questa reazione, calcola preliminarmente il suo effetto termico. Risposta: +65,43 kJ.
Soluzione:
G- gassoso, e- liquido, a- cristallino. Questi simboli vengono omessi se lo stato aggregato delle sostanze è evidente, ad esempio O 2, H 2, ecc.
L'equazione di reazione è:
2H 2 S (g) + CO 2 (g) \u003d 2H 2 O (g) + CS 2 (g); = ?
I valori dei calori standard di formazione delle sostanze sono riportati in apposite tabelle. Considerato che i calori di formazione delle sostanze semplici sono condizionatamente pari a zero. L'effetto termico della reazione può essere calcolato utilizzando il corollario e della legge di Hess:
\u003d (H 2 O) + (CS 2) - [(H 2 S) + (CO 2)];
= 2(-241,83) + 115,28 – = +65,43 kJ.
2H 2 S (g) + CO 2 (g) \u003d 2H 2 O (g) + CS 2 (g); = +65,43 kJ.
Risposta:+65,43 kJ.
Equazione di reazione termochimica
Compito 85.
Scrivi l'equazione termochimica per la reazione tra CO (g) e idrogeno, a seguito della quale si formano CH 4 (g) e H 2 O (g). Quanto calore verrà rilasciato durante questa reazione se si ottengono 67,2 litri di metano in condizioni normali? Risposta: 618,48 kJ.
Soluzione:
Le equazioni di reazione in cui il loro stato di aggregazione o modificazione cristallina, nonché il valore numerico degli effetti termici, sono indicati vicino ai simboli dei composti chimici, sono dette termochimiche. Nelle equazioni termochimiche, se non espressamente indicato, i valori degli effetti termici a pressione costante Qp sono indicati pari alla variazione dell'entalpia del sistema. Il valore viene solitamente fornito sul lato destro dell'equazione, separato da una virgola o da un punto e virgola. Sono accettate le seguenti abbreviazioni per lo stato aggregato della materia: G- gassoso, e- qualche cosa a- cristallino. Questi simboli vengono omessi se lo stato aggregato delle sostanze è evidente, ad esempio O 2, H 2, ecc.
L'equazione di reazione è:
CO (g) + 3H 2 (g) \u003d CH 4 (g) + H 2 O (g); = ?
I valori dei calori standard di formazione delle sostanze sono riportati in apposite tabelle. Considerato che i calori di formazione delle sostanze semplici sono condizionatamente pari a zero. L'effetto termico della reazione può essere calcolato utilizzando il corollario e della legge di Hess:
\u003d (H 2 O) + (CH 4) - (CO)];
\u003d (-241,83) + (-74,84) - (-110,52) \u003d -206,16 kJ.
L'equazione termochimica sarà simile a:
22,4 : -206,16 = 67,2 : X; x \u003d 67,2 (-206,16) / 22?4 \u003d -618,48 kJ; Q = 618,48 kJ.
Risposta: 618,48 kJ.
Calore di Formazione
Compito 86.
L'effetto termico di cui reazione è uguale al calore di formazione. Calcola il calore di formazione di NO dalle seguenti equazioni termochimiche:
a) 4NH 3 (g) + 5O 2 (g) \u003d 4NO (g) + 6H 2 O (g); = -1168,80 kJ;
b) 4NH 3 (g) + 3O 2 (g) \u003d 2N 2 (g) + 6H 2 O (g); = -1530,28 kJ
Risposta: 90,37 kJ.
Soluzione:
Il calore standard di formazione è uguale al calore di formazione di 1 mole di questa sostanza da sostanze semplici in condizioni standard (T = 298 K; p = 1.0325.105 Pa). La formazione di NO da sostanze semplici può essere rappresentata come segue:
1/2N 2 + 1/2O 2 = NO
Data la reazione (a) in cui si formano 4 moli di NO ed è data la reazione (b) in cui si formano 2 moli di N2. Entrambe le reazioni coinvolgono l'ossigeno. Pertanto, per determinare il calore standard di formazione di NO, componiamo il seguente ciclo di Hess, cioè dobbiamo sottrarre l'equazione (a) dall'equazione (b):

Quindi, 1/2N 2 + 1/2O 2 = NO; = +90,37 kJ.
Risposta: 618,48 kJ.
Compito 87.
Il cloruro di ammonio cristallino è formato dall'interazione di ammoniaca gassosa e acido cloridrico. Scrivi l'equazione termochimica per questa reazione, dopo aver calcolato il suo effetto termico. Quanto calore verrà rilasciato se nella reazione si consumassero 10 litri di ammoniaca in condizioni normali? Risposta: 78,97 kJ.
Soluzione:
Le equazioni di reazione in cui il loro stato di aggregazione o modificazione cristallina, nonché il valore numerico degli effetti termici, sono indicati vicino ai simboli dei composti chimici, sono dette termochimiche. Nelle equazioni termochimiche, se non espressamente indicato, i valori degli effetti termici a pressione costante Qp sono indicati pari alla variazione dell'entalpia del sistema. Il valore viene solitamente fornito sul lato destro dell'equazione, separato da una virgola o da un punto e virgola. Sono accettati i seguenti a- cristallino. Questi simboli vengono omessi se lo stato aggregato delle sostanze è evidente, ad esempio O 2, H 2, ecc.
L'equazione di reazione è:
NH 3 (g) + HCl (g) \u003d NH 4 Cl (k). ; = ?
I valori dei calori standard di formazione delle sostanze sono riportati in apposite tabelle. Considerato che i calori di formazione delle sostanze semplici sono condizionatamente pari a zero. L'effetto termico della reazione può essere calcolato utilizzando il corollario e della legge di Hess:
\u003d (NH4Cl) - [(NH 3) + (HCl)];
= -315,39 - [-46,19 + (-92,31) = -176,85 kJ.
L'equazione termochimica sarà simile a:
Il calore rilasciato durante la reazione di 10 litri di ammoniaca in questa reazione è determinato dalla proporzione:
22,4 : -176,85 = 10 : X; x \u003d 10 (-176,85) / 22,4 \u003d -78,97 kJ; Q = 78,97 kJ.
Risposta: 78,97 kJ.
Cosa si scalda più velocemente sul fornello: un bollitore o un secchio d'acqua? La risposta è ovvia: un bollitore. Allora la seconda domanda è perché?
La risposta non è meno ovvia, perché la massa d'acqua nel bollitore è inferiore. Eccellente. E ora puoi fare l'esperienza fisica più reale da solo a casa. Per fare questo, avrai bisogno di due piccole pentole identiche, una uguale quantità di acqua e olio vegetale, ad esempio mezzo litro ciascuna e un fornello. Mettere pentole di olio e acqua sullo stesso fuoco. E ora guarda cosa si scalderà più velocemente. Se c'è un termometro per liquidi puoi usarlo, in caso contrario puoi solo provare la temperatura di tanto in tanto con il dito, ma fai attenzione a non scottarti. In ogni caso, vedrai presto che l'olio si riscalda molto più velocemente dell'acqua. E un'altra domanda, che può essere implementata anche sotto forma di esperienza. Quale bolle più velocemente: acqua calda o fredda? Tutto è di nuovo ovvio: quello caldo sarà il primo a finire. Perché tutte queste strane domande ed esperimenti? Per determinare la quantità fisica chiamata "quantità di calore".
Quantità di calore
La quantità di calore è l'energia che il corpo perde o guadagna durante il trasferimento di calore. Questo è chiaro dal nome. Durante il raffreddamento, il corpo perderà una certa quantità di calore e, una volta riscaldato, lo assorbirà. E le risposte alle nostre domande ce lo hanno mostrato da cosa dipende la quantità di calore? In primo luogo, maggiore è la massa del corpo, maggiore è la quantità di calore che deve essere spesa per cambiare la sua temperatura di un grado. In secondo luogo, la quantità di calore necessaria per riscaldare un corpo dipende dalla sostanza di cui è composto, cioè dal tipo di sostanza. E in terzo luogo, anche la differenza di temperatura corporea prima e dopo il trasferimento di calore è importante per i nostri calcoli. Sulla base di quanto sopra, possiamo determinare la quantità di calore con la formula:
Q=cm(t_2-t_1) ,
dove Q è la quantità di calore,
m - peso corporeo,
(t_2-t_1) - la differenza tra la temperatura corporea iniziale e quella finale,
c - capacità termica specifica della sostanza, risulta dalle relative tabelle.
Usando questa formula, puoi calcolare la quantità di calore necessaria per riscaldare qualsiasi corpo o che questo corpo rilascerà quando si raffredda.
La quantità di calore è misurata in joule (1 J), come qualsiasi altra forma di energia. Tuttavia, questo valore è stato introdotto non molto tempo fa e le persone hanno iniziato a misurare la quantità di calore molto prima. E hanno usato un'unità ampiamente utilizzata ai nostri tempi: una caloria (1 cal). 1 caloria è la quantità di calore necessaria per aumentare la temperatura di 1 grammo di acqua di 1 grado Celsius. Guidati da questi dati, gli amanti del conteggio delle calorie nel cibo che mangiano possono, per motivi di interesse, calcolare quanti litri di acqua possono essere bolliti con l'energia che consumano con il cibo durante la giornata.
730. Perché l'acqua viene utilizzata per raffreddare alcuni meccanismi?
L'acqua ha un'elevata capacità termica specifica, che contribuisce a una buona rimozione del calore dal meccanismo.
731. In quale caso si dovrebbe spendere più energia: per riscaldare un litro d'acqua di 1 °C o per riscaldare cento grammi d'acqua di 1 °C?
Per riscaldare un litro d'acqua, poiché maggiore è la massa, maggiore è il consumo di energia.
732. Forchette di cupronichel e d'argento della stessa massa furono immerse in acqua calda. Ricevono la stessa quantità di calore dall'acqua?
Una forchetta in cupronichel riceverà più calore, perché il calore specifico del cupronichel è maggiore di quello dell'argento.
733. Un pezzo di piombo e un pezzo di ghisa della stessa massa furono colpiti tre volte con una mazza. Quale parte è diventata più calda?
Il piombo si riscalda di più perché la sua capacità termica specifica è inferiore alla ghisa e per riscaldare il piombo è necessaria meno energia.
734. Un pallone contiene acqua, l'altro contiene cherosene della stessa massa e temperatura. Un cubo di ferro ugualmente riscaldato è stato gettato in ogni fiaschetta. Cosa si riscalda a una temperatura più alta: acqua o cherosene?
Cherosene.
735. Perché gli sbalzi di temperatura in inverno e in estate sono meno bruschi nelle città sulla costa rispetto alle città situate nell'entroterra?
L'acqua si riscalda e si raffredda più lentamente dell'aria. In inverno si raffredda e sposta le masse d'aria calda sulla terraferma, rendendo il clima sulla costa più caldo.
736. La capacità termica specifica dell'alluminio è 920 J/kg °C. Cosa significa questo?
Ciò significa che occorrono 920 J per riscaldare 1 kg di alluminio di 1 °C.
737. Barre di alluminio e rame della stessa massa di 1 kg vengono raffreddate di 1 °C. Quanto cambierà l'energia interna di ogni blocco? Quale barra cambierà di più e di quanto?
738. Quale quantità di calore è necessaria per riscaldare di 45 °C un chilogrammo di billetta di ferro?

739. Quanto calore è necessario per riscaldare 0,25 kg di acqua da 30°C a 50°C?

740. Come cambierà l'energia interna di due litri d'acqua se riscaldata di 5 °C?

741. Quanto calore è necessario per riscaldare 5 g di acqua da 20 °C a 30 °C?
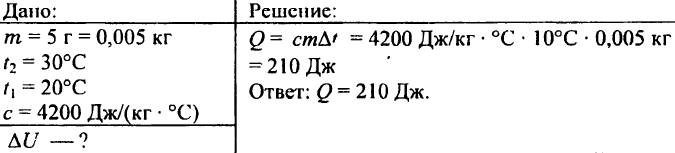
742. Quale quantità di calore è necessaria per riscaldare a 72 °C una palla di alluminio del peso di 0,03 kg?

743. Calcolare la quantità di calore necessaria per riscaldare 15 kg di rame di 80 °C.
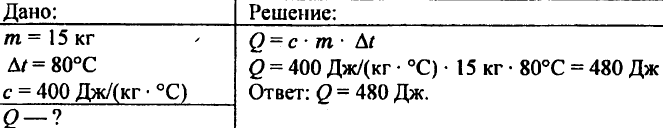
744. Calcolare la quantità di calore necessaria per riscaldare 5 kg di rame da 10 °C a 200 °C.

745. Quale quantità di calore è necessaria per riscaldare 0,2 kg di acqua da 15 °C a 20 °C?

746. L'acqua del peso di 0,3 kg si è raffreddata di 20 °C. Di quanto si riduce l'energia interna dell'acqua?

747. Quanto calore è necessario per riscaldare 0,4 kg di acqua ad una temperatura di 20 °C fino a una temperatura di 30 °C?

748. Quanto calore viene speso per riscaldare 2,5 kg di acqua di 20 °C?

749. Quanto calore è stato rilasciato quando 250 g di acqua si sono raffreddati da 90 °C a 40 °C?
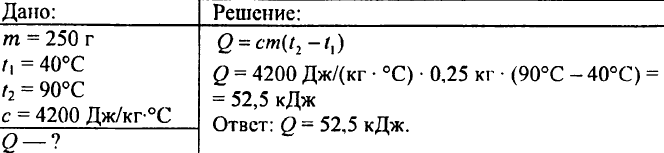
750. Quale quantità di calore è necessaria per riscaldare 0,015 litri di acqua di 1 °C?
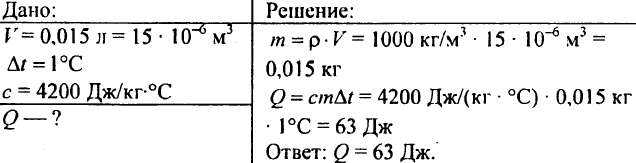
751. Calcolare la quantità di calore necessaria per riscaldare uno stagno con un volume di 300 m3 di 10 °C?

752. Quanto calore si deve impartire a 1 kg d'acqua per innalzarne la temperatura da 30°C a 40°C?
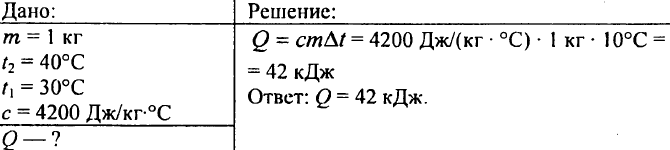
753. L'acqua con un volume di 10 litri si è raffreddata da una temperatura di 100 °C a una temperatura di 40 °C. Quanto calore viene rilasciato in questo caso?

754. Calcolare la quantità di calore necessaria per riscaldare 1 m3 di sabbia di 60 °C.

755. Volume d'aria 60 m3, capacità termica specifica 1000 J/kg °C, densità dell'aria 1,29 kg/m3. Quanto calore serve per portarla a 22°C?

756. L'acqua è stata riscaldata di 10 ° C, spendendo 4,20 103 J di calore. Determina la quantità di acqua.
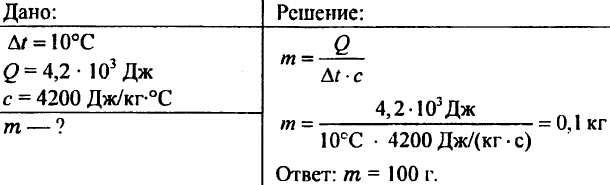
757. L'acqua del peso di 0,5 kg riportava 20,95 kJ di calore. Qual era la temperatura dell'acqua se la temperatura iniziale dell'acqua era di 20°C?

758. In una casseruola di rame del peso di 2,5 kg si versano 8 kg di acqua a 10 °C. Quanto calore serve per portare l'acqua a bollore in una casseruola?

759. In un mestolo di rame del peso di 300 g si versa un litro d'acqua alla temperatura di 15° C. Quanto calore è necessario per riscaldare l'acqua nel mestolo di 85° C?

760. Un pezzo di granito riscaldato del peso di 3 kg viene posto in acqua. Il granito trasferisce 12,6 kJ di calore all'acqua, raffreddandosi di 10 °C. Qual è la capacità termica specifica della pietra?

761. Acqua calda a 50°C è stata aggiunta a 5 kg di acqua a 12°C, ottenendo un impasto con temperatura di 30°C. Quanta acqua è stata aggiunta?

762. Acqua a 20°C è stata aggiunta a 3 litri di acqua a 60°C per ottenere acqua a 40°C. Quanta acqua è stata aggiunta?

763. Quale sarà la temperatura della miscela se si mescolano 600 g di acqua a 80 °C con 200 g di acqua a 20 °C?

764. Un litro d'acqua a 90°C fu versato in acqua a 10°C, e la temperatura dell'acqua divenne 60°C. Quanta acqua fredda c'era?
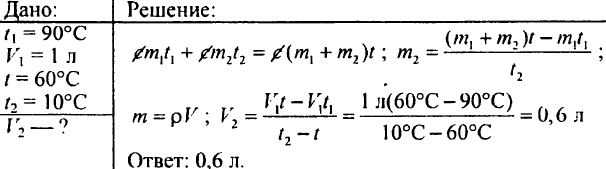
765. Determinare quanta acqua calda riscaldata a 60°C deve essere versata in un recipiente se il recipiente contiene già 20 litri di acqua fredda ad una temperatura di 15°C; la temperatura della miscela dovrebbe essere di 40 °C.

766. Determinare quanto calore è necessario per riscaldare 425 g di acqua di 20 °C.

767. Di quanti gradi si riscaldano 5 kg di acqua se l'acqua riceve 167,2 kJ?

768. Quanto calore è necessario per riscaldare m grammi di acqua da una temperatura t1 a una temperatura t2?
769. 2 kg di acqua vengono versati in un calorimetro ad una temperatura di 15 °C. A quale temperatura si riscalderà l'acqua del calorimetro se vi si abbassa un peso di ottone di 500 g riscaldato a 100 °C? La capacità termica specifica dell'ottone è 0,37 kJ/(kg °C).

770. Ci sono pezzi di rame, stagno e alluminio dello stesso volume. Quale di questi pezzi ha la capacità termica maggiore e quale la minore?

771. Nel calorimetro sono stati versati 450 g di acqua, la cui temperatura è di 20 °C. Immergendo in quest'acqua 200 g di limatura di ferro riscaldata a 100°C, la temperatura dell'acqua diventava di 24°C. Determinare la capacità termica specifica della segatura.

772. Un calorimetro di rame del peso di 100 g contiene 738 g di acqua, la cui temperatura è di 15 °C. 200 g di rame sono stati calati in questo calorimetro ad una temperatura di 100 °C, dopodiché la temperatura del calorimetro è salita a 17 °C. Qual è la capacità termica specifica del rame?

773. Una sfera d'acciaio del peso di 10 g viene estratta dal forno e calata in acqua alla temperatura di 10 °C. La temperatura dell'acqua salì a 25°C. Qual era la temperatura della pallina nel forno se la massa d'acqua è di 50 g? La capacità termica specifica dell'acciaio è 0,5 kJ/(kg °C).

777. Si versano 50 g di acqua a 19 °C in acqua del peso di 150 g alla temperatura di 35 °C. Qual è la temperatura della miscela?

778. L'acqua del peso di 5 kg a 90°C è stata versata in un bollitore di ghisa del peso di 2 kg ad una temperatura di 10°C. Qual era la temperatura dell'acqua?

779. Uno scalpello d'acciaio del peso di 2 kg è stato riscaldato ad una temperatura di 800 °C e poi calato in un recipiente contenente 15 litri di acqua alla temperatura di 10 °C. A quale temperatura verrà riscaldata l'acqua nel recipiente?

(Indicazione. Per risolvere questo problema, è necessario creare un'equazione in cui la temperatura desiderata dell'acqua nel recipiente dopo che il cutter è stato abbassato viene presa come incognita.)
780. Che temperatura raggiunge l'acqua se si mescolano 0,02 kg di acqua a 15 °C, 0,03 kg di acqua a 25 °C e 0,01 kg di acqua a 60 °C?

781. Il riscaldamento di una classe ben ventilata richiede una quantità di calore di 4,19 MJ all'ora. L'acqua entra nei radiatori del riscaldamento a 80°C ed esce a 72°C. Quanta acqua dovrebbe essere fornita ai radiatori ogni ora?

782. Il piombo del peso di 0,1 kg alla temperatura di 100 °C è stato immerso in un calorimetro di alluminio del peso di 0,04 kg contenente 0,24 kg di acqua alla temperatura di 15 °C. Successivamente, nel calorimetro è stata stabilita la temperatura di 16 °C. Qual è la capacità termica specifica del piombo?

In questa lezione impareremo come calcolare la quantità di calore necessaria per riscaldare un corpo o rilasciarlo quando si raffredda. Per fare ciò, riassumeremo le conoscenze acquisite nelle lezioni precedenti.
Inoltre, impareremo come utilizzare la formula per la quantità di calore per esprimere le quantità rimanenti da questa formula e calcolarle, conoscendo altre quantità. Verrà anche preso in considerazione un esempio di problema con una soluzione per il calcolo della quantità di calore.
Questa lezione è dedicata al calcolo della quantità di calore quando un corpo viene riscaldato o rilasciato da esso quando viene raffreddato.
La capacità di calcolare la quantità di calore richiesta è molto importante. Ciò può essere necessario, ad esempio, per calcolare la quantità di calore che deve essere conferita all'acqua per riscaldare una stanza.
Riso. 1. La quantità di calore che deve essere comunicata all'acqua per riscaldare la stanza
Oppure per calcolare la quantità di calore che viene rilasciata quando il carburante viene bruciato in vari motori:

Riso. 2. La quantità di calore rilasciata quando il carburante viene bruciato nel motore
Inoltre, questa conoscenza è necessaria, ad esempio, per determinare la quantità di calore che viene rilasciata dal Sole e colpisce la Terra:

Riso. 3. La quantità di calore rilasciata dal Sole e che cade sulla Terra
Per calcolare la quantità di calore, devi sapere tre cose (Fig. 4):
- peso corporeo (che di solito può essere misurato con una bilancia);
- la differenza di temperatura per la quale è necessario riscaldare o raffreddare il corpo (solitamente misurata con un termometro);
- capacità termica specifica del corpo (che può essere determinata dalla tabella).

Riso. 4. Cosa devi sapere per determinare
La formula per calcolare la quantità di calore è la seguente:
Questa formula contiene le seguenti quantità:
La quantità di calore, misurata in joule (J);
La capacità termica specifica di una sostanza, misurata in;
- differenza di temperatura, misurata in gradi Celsius ().
Considera il problema del calcolo della quantità di calore.
Un compito
Un bicchiere di rame con una massa di grammi contiene acqua con un volume di un litro ad una temperatura di . Quanto calore deve essere trasferito a un bicchiere d'acqua affinché la sua temperatura diventi uguale a?

Riso. 5. Illustrazione della condizione del problema
Per prima cosa, scriviamo una breve condizione ( Dato) e convertire tutte le quantità nel sistema internazionale (SI).
|
Dato: |
SI |
|
|
Trova: |
Soluzione:
Innanzitutto, determina quali altre quantità ci servono per risolvere questo problema. Secondo la tabella della capacità termica specifica (Tabella 1), troviamo (capacità termica specifica del rame, poiché per condizione il vetro è rame), (capacità termica specifica dell'acqua, poiché per condizione c'è acqua nel vetro). Inoltre, sappiamo che per calcolare la quantità di calore, abbiamo bisogno di una massa d'acqua. Per condizione, ci viene dato solo il volume. Pertanto, prendiamo la densità dell'acqua dalla tabella: (Tabella 2).
Tab. 1. Capacità termica specifica di alcune sostanze,
Tab. 2. Densità di alcuni liquidi
Ora abbiamo tutto ciò di cui abbiamo bisogno per risolvere questo problema.
Si noti che la quantità totale di calore consisterà nella somma della quantità di calore necessaria per riscaldare il vetro di rame e la quantità di calore necessaria per riscaldare l'acqua al suo interno:
Per prima cosa calcoliamo la quantità di calore necessaria per riscaldare il vetro di rame:
Prima di calcolare la quantità di calore necessaria per riscaldare l'acqua, calcoliamo la massa d'acqua usando la formula a noi familiare dal grado 7:
Ora possiamo calcolare:
Allora possiamo calcolare:
Ricorda cosa significa: kilojoule. Il prefisso "chilo" significa ![]() .
.
Risposta:.
Per comodità di risolvere i problemi di trovare la quantità di calore (i cosiddetti problemi diretti) e le quantità associate a questo concetto, puoi utilizzare la tabella seguente.
|
Valore desiderato |
Designazione |
Unità |
Formula di base |
Formula per quantità |
|
Quantità di calore |
Obiettivo didattico: Introdurre i concetti di quantità di calore e capacità termica specifica.
Obiettivo dello sviluppo: coltivare la consapevolezza; imparare a pensare, trarre conclusioni.
1. Aggiornamento dell'argomento
2. Spiegazione del nuovo materiale. 50 min.
Sai già che l'energia interna di un corpo può cambiare sia svolgendo un lavoro che trasferendo calore (senza fare lavoro).
L'energia che un corpo riceve o perde durante il trasferimento di calore è chiamata quantità di calore. (voce del taccuino)
Ciò significa che anche le unità di misura della quantità di calore sono Joule ( J).
Conduciamo un esperimento: due bicchieri in uno da 300 g di acqua e nell'altro da 150 g e un cilindro di ferro del peso di 150 g Entrambi i bicchieri sono posizionati sulla stessa piastrella. Dopo qualche tempo, i termometri mostreranno che l'acqua nella nave in cui si trova il corpo si riscalda più velocemente.
Ciò significa che per riscaldare 150 g di ferro è necessario meno calore che per riscaldare 150 g di acqua.
La quantità di calore trasferita al corpo dipende dal tipo di sostanza di cui è composto il corpo. (voce del taccuino)
Proponiamo la domanda: è necessaria la stessa quantità di calore per riscaldare corpi di uguale massa, ma costituiti da sostanze diverse, alla stessa temperatura?
Conduciamo un esperimento con il dispositivo Tyndall per determinare la capacità termica specifica.
Concludiamo: corpi di diverse sostanze, ma della stessa massa, emanano quando sono raffreddati e richiedono una diversa quantità di calore quando riscaldati dello stesso numero di gradi.
Traiamo conclusioni:
1. Per riscaldare alla stessa temperatura corpi di uguale massa, costituiti da diverse sostanze, è necessaria una diversa quantità di calore.
2. Corpi di uguale massa, costituiti da diverse sostanze e riscaldati alla stessa temperatura. Quando si raffreddano dello stesso numero di gradi, emanano una diversa quantità di calore.
Ne deduciamo che la quantità di calore richiesta per aumentare di un grado la massa unitaria di diverse sostanze sarà diversa.
Diamo la definizione di capacità termica specifica.
La quantità fisica, numericamente uguale alla quantità di calore che deve essere trasferita a un corpo di massa 1 kg affinché la sua temperatura cambi di 1 grado, è chiamata calore specifico della sostanza.
Introduciamo l'unità di misura della capacità termica specifica: 1J/kg * grado.
Il significato fisico del termine : la capacità termica specifica mostra quanto cambia l'energia interna di 1 g (kg.) di una sostanza quando viene riscaldata o raffreddata di 1 grado.
Considera la tabella delle capacità termiche specifiche di alcune sostanze.
Risolviamo il problema analiticamente
Quanto calore è necessario per riscaldare un bicchiere d'acqua (200 g) da 20 0 a 70 0 C.
Per riscaldare 1 g per 1 g Richiesto - 4,2 J.
E per riscaldare 200 g per 1 g, ce ne vorranno altri 200 - 200 * 4,2 J.
E per riscaldare 200 g di (70 0 -20 0) ci vorrà un altro (70-20) in più - 200 * (70-20) * 4,2 J
Sostituendo i dati, otteniamo Q = 200 * 50 * 4,2 J = 42000 J.
Scriviamo la formula risultante in termini di quantità corrispondenti
4. Cosa determina la quantità di calore ricevuta dal corpo quando riscaldato?
Si noti che la quantità di calore richiesta per riscaldare un corpo è proporzionale alla massa del corpo e al cambiamento della sua temperatura.,
Ci sono due cilindri della stessa massa: ferro e ottone. È necessaria la stessa quantità di calore per riscaldarli dello stesso numero di gradi? Come mai?
Quanto calore è necessario per riscaldare 250 g di acqua da 20° a 60°C.
Qual è il rapporto tra calorie e joule?
Una caloria è la quantità di calore necessaria per aumentare di 1 grado la temperatura di 1 grammo di acqua.
1 cal = 4,19=4,2 J
1kcal=1000cal
1kcal=4190J=4200J
3. Risoluzione dei problemi. 28 min.
Se riscaldati in acqua bollente, i cilindri di piombo, stagno e acciaio del peso di 1 kg vengono posti sul ghiaccio, si raffredderanno e parte del ghiaccio sotto di essi si scioglierà. Come cambierà l'energia interna dei cilindri? Sotto quale dei cilindri si scioglierà più ghiaccio, sotto quale meno?
Una pietra riscaldata con una massa di 5 kg. Raffreddando in acqua di 1 grado, trasferisce ad esso 2,1 kJ di energia. Qual è la capacità termica specifica della pietra
Durante l'indurimento di uno scalpello, è stato prima riscaldato a 650 0, quindi abbassato nell'olio, dove si è raffreddato a 50 0 C. Quale quantità di calore veniva rilasciata se la sua massa era di 500 g.
Quanto calore è stato speso per riscaldare da 20 0 a 1220 0 C. una billetta d'acciaio per l'albero motore di un compressore del peso di 35 kg.
Lavoro indipendente
Che tipo di trasferimento di calore?
Gli studenti completano la tabella.
- L'aria nella stanza viene riscaldata attraverso le pareti.
- Attraverso una finestra aperta in cui entra aria calda.
- Attraverso il vetro, che trasmette i raggi del sole.
- La terra è riscaldata dai raggi del sole.
- Il liquido viene riscaldato sul fornello.
- Il cucchiaio d'acciaio viene riscaldato dal tè.
- L'aria è riscaldata da una candela.
- Il gas si muove intorno alle parti che producono calore della macchina.
- Riscaldare la canna di una mitragliatrice.
- Latte bollente.
5. Compiti a casa: Peryshkin A.V. “Fisica 8” §§7, 8; raccolta di compiti 7-8 Lukashik V.I. nn. 778-780, 792.793 2 min.